Đóng và mở kênh ion: Ba trạng thái hoạt động
Tế bào là một hệ thống mở thường xuyên trao đổi chất và năng lượng với môi trường bên ngoài. Khả năng này được đảm bảo nhờ một loạt các cấu trúc vận chuyển tinh vi trải xuyên qua màng lipid kép. Protein tải (transporters) và kênh (channels) là hai nhóm lớn của protein vận chuyển ở màng tế bào. Protein tải còn được gọi là chất mang (carriers) hoặc chất cho thấm qua (permeases) sẽ gắn chặt với các chất tan đặc hiệu được vận chuyển và sẽ trải qua một loạt các biến đổi hình thể dể chuyển chất tan qua màng tế bào. Người ta phân làm 2 nhóm theo nhu cầu năng lượng: tải chủ động và tải thụ động. Trong khi, kênh hình thành nên những ống dẫn xuyên qua lớp lipid kép, khi mở, cho phép những chất tan đặc hiệu (thường là các phân tử vô cơ vừa phải và tích điện) đi qua và nhờ đó mà vào tế bào. Ngược với các tải, kênh tương tác với các chất tan yếu hơn rất nhiều, dễ hiểu là sự vận chuyển qua các kênh xảy ra nhanh hơn nhiều so với các tải: hiệu quả vận chuyển gấp 100000 lần nhanh hơn protein tải nhanh nhất, vào khoảng 100 tỉ ion có thể chảy qua một kênh ion trong một giây. Đối với nước, mặc dù có thể khuếch tán qua lớp lipid kép nhưng tất cả các tế bào đều chứa kênh đặc hiệu (còn gọi là kênh nước hay aquaporins) làm tăng rất lớn tính thấm của màng tế bào với nước.
Với tốc độ vận chuyển khổng lồ của các kênh ion, tế bào sẽ nhanh chóng đạt đến trạng thái cân bằng đối với tất cả các ion giữa 2 bên màng tế bào – trạng thái cân bằng vĩnh viễn, điều đó chẳng khác nào là sự kết thúc cho hệ thống sống luôn vậng động trao đổi, nếu không có một cơ chế điều hòa đóng mở kênh ion. Có 3 trạng thái hoạt động của các kênh ion, ở đây bàn về các kênh ion mà mỗi trạng thái ĐÓNG – MỞ – BẤT HOẠT phụ thuộc vào từng phân độ điện thế màng tế bào biến đổi theo thời gian. Để cụ thể hơn, xin lấy kênh ion Na phụ thuộc điện thế (phổ biến nhất đặc biệt trong các tế bào dễ kích thích như: tế bào cơ bắp, cơ tim, neuron) làm minh họa:

Hình 25.1: A: Một kích thích lên màng tế bào khởi động một sóng ngắn khử cực nhẹ. B: Đường biểu diễn màu xanh cho thấy điện thế màng đáng lẽ sẽ nhanh chóng trở về trạng thái nghỉ ban đầu nếu không có các kênh ion Na phụ thuộc điện thế trên màng tế bào. Sự hồi phục chậm chạp này gây ra bởi sự mở ra của kênh ion K phụ thuộc điện thế đáp ứng với một kích thích, từ đó đưa điện thế màng quay về giá trị cân bằng. Trên thực tế, các kênh ion Na phụ thuộc điện thế đã mở làm biến đổi lớn điện thế màng được biểu diễn bằng đường cong màu đỏ. C: Thể hiện từng trạng thái hoạt động theo thời gian của kênh Na phụ thuộc điện thế (Cụ thể biến đổi sẽ được bàn luận chi tiết trong phần sau). Ngay lúc điện thế màng đạt giá trị khoảng +50mV, kênh Na nhanh chóng bất hoạt và duy trì trạng thái bất hoạt này cho đến khi màng tế bào trở về điện thế nghỉ, mới chuyển sang trạng thái ban đầu “đóng” ở mức điện thế nghỉ màng: -80mV. Trước lúc này, màng tế bào trơ với kích thích hay không thể phát động sóng khử cực thứ hai
Natri và Kali, kênh và bơm
Trước khi tìm hiểu tầm quan trọng của những kim loại kiềm Natri và Kai, chúng ta nên ôn lại thật kỹ cách các ions này được vận chuyển qua màng tế bào. Như đã biết, lớp phospholipid kép của màng sinh học về cơ bản thì không thấm đối với những phân tử phân cực và những ions như Na+ và K+– tính thấm của những ions này (được diễn tả theo cm-1) là từ 10-12, còn đối với H2O là khoảng 10-2 (nên thấm dễ dàng hơn). Vận chuyển qua màng tế bào liên quan đến 2 loại protein màng, đó là kênh và bơm. Kênh thì cho phép các ions đi qua thuậntheo chiều gradient nồng độ qua quá trình vận chuyển thụ động hay khuếch tán có hỗ trợ. Tất nhiên, những kênh này không thể mở liên tục được, và như vậy chúng được đóng (gated), giống như cổng vườn, chúng thường xuyên đóng và chỉ có thể được mở ra khi có ligand gắn vào (ligand-gated) hoặc có sự thay đổi điện thế màng tế bào (voltage-gated). Những kênh ligand-gated, ví dụ như những thụ thể acetylcholine ở màng sau synapse, được mở ra bởi chất dẫn truyền thần kinh acetylcholine; còn những kênh voltage-gated Natri và Kali, điểu biến điện thế động ở những sợi trục thần kinh được mô tả bên dưới, thì lại được mở ra bởi sự khử cực màng tế bào.
Ngược lại, bơm thì sử dụng năng lượng dưới dạng ATP hay ánh sáng để điều khiển sự vận chuyển không thuận lợi của những ions hay phân tử đi ngược chiều gradient nồng độ, nói cách khác, chúng liên quan đến vận chuyển chủ động. Có 2 loại bơm cần ATP là P-type ATPase và ABC (ATP-biding cassette). Chúng đều thay đổi hình dạng khi có ATP gắn vào và kết quả là khử hydro để vận chuyển ions qua màng tế bào.Bơm Na+-K+-ATPase được mô tả bên dưới là một trong những loại P-type ATPases. Cách vận chuyển chủ động khác là dùng gradient điện hoá học của 1 ion để vận chuyển ngược ion khác, được minh hoạ bằng bơm trao đổi Na+/H+ có vai trò rất quan trọng trong việc điều chỉnh pH nội bào. Còn 1 ví dụ khác được đề cập trước đây là bơm trao đổi Na+/Ca2+, quan trọng trong việc lấy Ca2+ ra khỏi tế bào.
So sánh Natri và Kali
Natri và Kali có rất nhiều trong lớp vỏ trái đất, mặc dù Na thì thường thấy hơn trong nước biển. Lượng Na+ và K+ ở người bình thường ttheo thứ tự là khoảng 1.4 và 2.0 g/kg. Chúng là những ion kim loại quan trong nhất về mặt nồng độ trong cơ thể người. Tuy nhiên chúng phân bố hơi khác nhau. Trong khi ở tế bào của loài động vật có vú, 98% K+ở trong tế bào thì Na+ ngược lại.Sư khác biệt về nồng độ đảm bảo cho 1 loạt quá trình sinh học được xảy ra, ví dụ như sự cân bằng độ thẩm thấu tế bào, sự phiên dịch tín hiệu và dẫn truyền thần kinh. Chúng được duy trì bởi bơm Na+-K+-ATPase, sẽ được đề cập bên dưới. Tuy nhiên, mặc dù chỉ có 2% K+ hiện diện ngoài tế bào, nồng độ K+ ngoại bào này đóng vai trò rất quan trong trong việt duy trì điện thế nghỉ của màng tế bào.Những dòng ion kim loại này quyết định sự dẫn truyền các xung thần kinh trong não và từ não dến các phần khác của cơ thể. Sự đóng và mở của những kênh có cổng ion (gated channels), bình thường đóng ở trong thái nghỉ, và mở đáp ứng lại với những thay đổi điện thế màng, tạo ra những gradient điện hoá học ở phía bên kia của màng bào tương của các neurons. Một xung thần kinh được tạo ra bởi một sóng khử cực/tái cực ngắn ngủi của màng, ngang qua tế bào thần kinh gọi là điện thế động. Hodgkin và Huxley (1952) đã chứng minh rằng cấy một điện cực nhỏ vào một sợi trục ( tiến trình dài xuất phát từ thân tế bào thần kinh) thì tạo ra một điện thế động. Trong ~0.5ms đầu, điện thế màng tăng từ khoản – 60mV lên khoảng +30mV, gây ra sư tái cực nhanh làm tăng quá mức điện thế nghỉ (quá khử cực) trước khi hồi phục một cách chậm chạp. Điện thế động này là kết quả của sự tăng nhanh và ngắn tính thấm của Na+ theo sau sự tăng kéo dài tính thấm của K+. Sự đóng-mở của những kênh ion Na+ và K+ này qua màng sợi trục tạo ra những điện thế động (gradient điện thế cơ bản) xuyên màng, giúp truyền thông tin cũng như điều hoà chức năng tế bào.

Hình 25.2: Biểu đồ của điện thế động. (Voet and Voet, 2004)
Sự điều hoà dòng chảy ion xuyên qua màng tế bào hiển nhiên cần thiết cho chức năng của các tế bào sống. Vì tính kỵ nước của màng tế bào (đã đề cập ở trên), sự vận chuyển nhờ năng lượng ưu tiên những loại ions như Na+, K+, Cl–, H+ và Ca2+ đi qua màng mà không tính đến việc cần chúng ở bên này hay bên kia màng sinh học, sẽ không khả thi. Nếu không có gradient ion giúp duy trì nồng độ K cao và nồng độ Na thấp trong tế bào, tế bào sẽ không thể thực hiện những hoạt động chuyển hoá bình thường. Điều này nôm na là vài cỗ máy phân tử phải có khả năng phân biệt giữa ion Na+ và K+ ( giả sử rằng không ngậm nước, vì mức độ hydrat hoá có thể gây khó khăn cho sự phân biệt này). Vì vậy trước khi bắt đầu thảo luận về những proteins vận chuyển ‘chủ động’ hoặc bơm ion hay bơm trao đổi ion, chúng ta tự hỏi bằng cách nào những chất vận chuyển này nhận ra được sự khác biệt giữa 2 cations có quan hệ chặt chẽ trên.(Được diễn giải trong Corry và Chung, 2006; Goax và MacKinnon, 2005.)
Nếu chúng ta được hỏi câu này trong vài năm về trước, câu trả lời sẽ là không rõ ràng. Tuy nhiên, nhờ những công trình lớn tìm hiểu cấu trúc những proteins màng, hiện giờ chúng ta có thể trả lời được, trên cơ sở càng ngày có càng nhiều cấu trúc X-quang của những proteins vận chuyển ion, bắt đầu thúc đẩy những giả thuyết ngày càng có khả năng thành sự thật. Trong trường hợp của kênh Na+, chúng ta vẫn còn hơi mơ hồ. Tuy nhiên, sự phân biệt thành công cấu trúc của một số lớnkênh K+ của cả vi khuẩn và những loài động vật hữu nhũ cho thấy một bước tiến vượt bậc trong tri thức của loài người về chức năng của những kênh này.
Kênh Kali
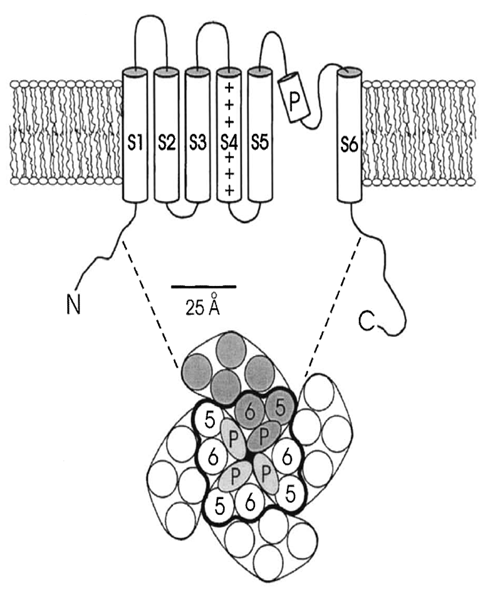
Những kênh K vận chuyển chọn lọc K đi qua màng, làm quá phân cực tế bào, tạo điện thế màng và điều khiển độ dài của điện thế động bên cạnh vô số những chức năng khác nữa. Chúng sử dụng những dạng cổng khác nhau, nhưng chúng lại có tính thấm đối với ion giống nhau. Tất cả kênh K đều có tính chọn lọc theo thứ tự K+ ~ Rb+> Cs+, trong khi sự vận chuyển của những ion kim loại kiềm nhỏ nhất là Na+ và Li+ thì rất chậm – tính thấm của K+ ít nhất gấp 104 lần tính thấm của Na+. Sự xác định cấu trúc X-quang của kênh ion K đã cho phép chúng ta hiểu được cách nó lọc một cách chọn lọc những ion K+ được khử nước hoàn toàn mà không phải là ion Na+ nhỏ hơn. Phân tử lọc này không những chọn lọc ions để được vận chuyển, mà còn là lực đẩy tĩnh điện giữa những ions K với nhau, chúng đi qua phân tử lọc này trong tài liệu của những nhà khoa học Ấn Độ, cung cấp lực để chuyển những ions K nhau qua kênh với tần số 107-108 một giây. (Được đề cập trong Doyle và cộng sự, 1998, MacKinnon, 2004.)

Hình 25.3: Sơ đồ phác họa mặt cắt ngang kênh K+, cấu tạo một tiểu đơn vị được trải ra.

Hình 25.4: (a) Cấu trúc của kênh K+ KcsA với 2 trong 4 tiểu đơn vị được bỏ ra: những vòng xoắn của khe màu đỏ, bộ lọc chọn lọc màu vàng; mật độ electron dọc theo đường đi của ion màu xanh lam. (b) Bộ lọc chọn lọc K+ ( 2 tiểu đơn vị) với 8 nhóm carbonyl (màu đỏ) tương ứng với ion K (màu xanh lục) ở những vị trí 1-4 từ mặt ngoại bào (Từ MacKinnon, 2004. Được vẽ lại với sự cho phép của John Wiley & Sons., Inc.)
Kênh K cổng điện thế đầu tiên được xác định là đoạn gene mã hoáđột biến Shaker ở loài ruồi giấm Drosophila. Hiện tại chúng ta có những cấu trúc kênh K của vi khuẩn phụ thuộc pH, những kênh K+ cổng điện thế và cổng calci (calcium-gated) của vi khuẩn và gần đây nhất là kênh K cổng điện thế của động vật hữu nhũ. Điều khó khăn nhất là chúng đều có cấu trúc giống nhau. Chúng đều là tetramers với cấu hình gấp 4 quanh trung tâm K+ – khe chỉ đạo (conducting pore). Trên cơ sở nghiên cứ tính kỵ nước, có 2 phân nhóm kênh K+ liên quan mật thiết với nhau, một nhóm bao gồm những phân đoạn có độ dài 2 màng mỗi tiểu đơn vị và một nhóm có 6. Trong trường hợp sau, ởnhững kênh K+ cổng điện thế của Drosophila và động vật có xương sống, 2 vòng xoắn xuyên màng cuối cùng, S5 và S6 cùng với vòng P (P-loop) liên kết chúng, tạo thành khe chỉ đạo. Nhiều nhóm khác của kênh ions có cấu trúc giống nhau, bao gồm kênh K+ được hoạt hoá bởi Calci (Calcium-activated K+ channel). Nhóm 2 màng bao gồm kênh K+ bên trong thẳng và vài kênh K+ của vi khuẩn. Chúng được tạo thành từ 4 tiểu đơn vị, mỗi cái chỉ có 2 phân đoạn xuyên màng. 2 phân đoạn M1 và M2 giống nhau và vòng khe tạo thành cấu trúc xuyên màng hoàn chỉnh của 2 kênh K+ xuyên màng trên. Sự tương đồng về trình tự rất cao giữa 2 nhóm trong vùng kênh, đặc biệt là trong vùng khe. Các kênh K+ cho phép vài cations hoá trị I đi qua (nhưng không phải là Na), nhưng không cho phép các anions đi qua và bị chặn bởi các cations hoá trị II.
Phùng Trung Hùng – Phạm Thiên Tánh – Nguyễn Phước Long – Lê Phi Hùng
Xem toàn bộ bài viết tại đây.